El
primer principio de la termodinámica o
primera ley de la termodinámica,
[1] se postula a partir del siguiente hecho experimental:
En un sistema cerrado adiabático (aislado) que evoluciona de un estado inicial

a otro estado final
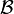
, el trabajo realizado no depende ni del tipo de trabajo ni del proceso seguido.
Más formalmente, este principio se descompone en dos partes;
- El «principio de la accesibilidad adiabática»
- y un «principio de conservación de la energía»:
El
trabajo de la conexión adiabática entre dos estados de equilibrio de un sistema cerrado depende exclusivamente de ambos estados conectados.
Este enunciado supone formalmente definido el concepto de
trabajo termodinámico, y sabido que los sistemas termodinámicos sólo pueden interaccionar de tres formas diferentes (interacción másica, interacción mecánica e interacción térmica). En general, el trabajo es una magnitud física que no es una variable de estado del sistema, dado que depende del proceso seguido por dicho sistema. Este hecho experimental, por el contrario, muestra que para los sistemas cerrados adiabáticos, el trabajo no va a depender del proceso, sino tan solo de los estados inicial y final. En consecuencia, podrá ser identificado con la variación de una nueva variable de estado de dichos sistemas, definida como
energía interna.
Se define entonces la energía interna,
U,como una variable de estado cuya variación en un proceso adiabático es el trabajo intercambiado por el sistema con su entorno:

Cuando el sistema cerrado evoluciona del estado inicial A al estado final B pero por un proceso no adiabático, la variación de la Energía debe ser la misma, sin embargo, ahora, el trabajo intercambiado será diferente del trabajo adiabático anterior. La diferencia entre ambos trabajos debe haberse realizado por medio de interacción térmica. Se define entonces la cantidad de energía térmica intercambiada
Q (calor) como:
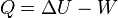
Esta definición suele identificarse con la ley de la
conservación de la energía y, a su vez, identifica el
calor como una transferencia de
energía. Es por ello que la ley de la conservación de la energía se utilice, fundamentalmente por simplicidad, como uno de los enunciados de la primera ley de la termodinámica:
En su forma matemática más sencilla se puede escribir para cualquier sistema cerrado:
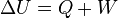
donde:
 es la variación de energía del sistema,
es la variación de energía del sistema,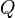 es el calor intercambiado por el sistema a través de unas paredes bien definidas, y
es el calor intercambiado por el sistema a través de unas paredes bien definidas, y es el trabajo intercambiado por el sistema a sus alrededores
es el trabajo intercambiado por el sistema a sus alrededores
Bibliografia:
http://es.wikipedia.org/wiki/Primera_ley_de_la_termodin%C3%A1mica
 a otro estado final
a otro estado final 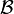 , el trabajo realizado no depende ni del tipo de trabajo ni del proceso seguido.
, el trabajo realizado no depende ni del tipo de trabajo ni del proceso seguido.
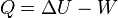
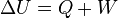
 es la variación de energía del sistema,
es la variación de energía del sistema,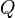 es el calor intercambiado por el sistema a través de unas paredes bien definidas, y
es el calor intercambiado por el sistema a través de unas paredes bien definidas, y es el trabajo intercambiado por el sistema a sus alrededores
es el trabajo intercambiado por el sistema a sus alrededores