TRANSFERENCIA DE CALOR POR CONDUCCIÓN
TRANSFERENCIA DE CALOR POR CONVECCIÓN
Si existe una diferencia de temperatura en el interior de un líquido o un
gas, es casi
seguro que se producirá un movimiento del fluido. Este movimiento transfiere calor de una parte del fluido a otra por un proceso llamado convección. El movimiento del fluido puede ser natural o forzado. Si se calienta un líquido o un gas, su densidad (masa por unidad de volumen) suele disminuir. Si el líquido o gas se encuentra en el campo gravitatorio, el fluido más caliente y menos denso asciende, mientras que el fluido más frío y más denso desciende. Este tipo de movimiento, debido exclusivamente a la no uniformidad de la temperatura del fluido, se denomina convección natural. La convección forzada se logra sometiendo el fluido a un gradiente de presiones, con lo que se
fuerza su movimiento de acuerdo a las
leyes de la
mecánica de fluidos.
Supongamos, por ejemplo, que calentamos desde abajo una cacerola llena de
agua. El líquido más próximo al fondo se calienta por el calor que se ha transmitido por conducción a través de la cacerola. Al expandirse, su densidad disminuye y como resultado de ello el agua caliente asciende y parte del fluido más frío baja hacia el fondo, con lo que se inicia un movimiento de circulación. El líquido más frío vuelve a calentarse por conducción, mientras que el líquido más caliente situado arriba pierde parte de su calor por radiación y lo cede al
aire situado por encima.
TRANSFERENCIA DE CALOR POR RADIACIÓN
La teoría
estadística de la radiación representó un enorme papel en el
desarrollo de la teoría cuántica. La teoría electromagnética clásica de la
luz, que había explicado un amplio círculo de fenómenos vinculados con la propagación de la luz, y que había logrado aceptación general a fines del S. XIX, a
principios del S. XX se encontró con dificultades insuperables en relación con el problema de la emisión de la luz y, en particular, con el de la radiación térmica. Entendemos por radiación térmica toda la radiación emitida por un cuerpo calentado.
Como es sabido, el
carácter de la luz emitida y, en particular, su intensidad, como también la dependencia de ésta respecto de la frecuencia (composición espectral de la radiación) están determinados por la temperatura y la naturaleza del cuerpo emisor.
Sin embargo, hay un caso en que la composición espectral de la radiación es independiente de la naturaleza del emisor y viene determinada exclusivamente por su temperatura. Se trata de la llamada radiación de
equilibrio.
Imaginemos una cavidad cerrada, con paredes que no dejan pasar el calor y mantenidas a una determinada temperatura T. Las paredes de la cavidad emitirán y absorberán
ondas electromagnéticas.
Dado que toda la radiación electromagnética se encuentra confinada en la cavidad cerrada, al cabo de un cierto tiempo se establecerá en el
sistema un estado de equilibrio estadístico. Las paredes de la cavidad emitirán, por unidad de tiempo, la misma energía electromagnética que absorben. En la cavidad existirá un sistema de ondas electromagnéticas estacionarias que no variarán con el tiempo.
La densidad de energía del correspondiente campo electromagnético dentro de la cavidad se expresa como:
La radiación térmica contendrá diferentes frecuencias. La densidad de energía

que corresponde a un intervalo de frecuencias dado d
v, será distinta, evidentemente, para las diferentes frecuencias. La densidad de energía de la radiación de frecuencia dada dependerá también de la temperatura
T de las paredes emisoras. De esta manera,
Un simple razonamiento termodinámico prueba si embargo, que

es independiente de la naturaleza del emisor, en particular, de las paredes (de las propiedades absorbentes y emisoras, del estado de la superficie, etc.).
Consideremos, en efecto, dos cavidades cuyas paredes se calientan hasta la misma temperatura, pero constituidas por materiales distintos. Supongamos que la densidad de la energía espectral de la radiación dependa de la naturaleza del emisor y sea diferente en una y otra cavidad. Entonces, poniendo en
comunicación ambas cavidades, es posible romper el equilibrio. La radiación pasará a aquella cavidad en la que su densidad sea menor. Como resultado de esto, la densidad de radiación de dicha cavidad crecerá, las paredes de la misma absorberán más energía, y su temperatura se elevará. Entre las paredes de ambas cavidades se establece una diferencia de temperaturas que se puede utilizar para obtener trabajo útil.
bibliografia:
 a otro estado final
a otro estado final 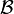 , el trabajo realizado no depende ni del tipo de trabajo ni del proceso seguido.
, el trabajo realizado no depende ni del tipo de trabajo ni del proceso seguido.
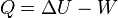
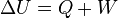
 es la variación de energía del sistema,
es la variación de energía del sistema,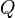 es el calor intercambiado por el sistema a través de unas paredes bien definidas, y
es el calor intercambiado por el sistema a través de unas paredes bien definidas, y es el trabajo intercambiado por el sistema a sus alrededores
es el trabajo intercambiado por el sistema a sus alrededores